Konfigurasi Elektron Dan Elektron Valensi
Selamat hadir di Atap Ilmu, blog sederhana yang membuatkan ilmu pengetahuan dengan penuh keikhlasan. Kali ini kami akan membuatkan ilmu ihwal KONFIGURASI ELEKTRON, beberapa topik utamanya ialah Pengertian Konfigurasi Elektron, Sejarah Konfigurasi Elektron, Konfigurasi Elektron Berdasarkan Kulit Atom, Elektron Valensi, Peraturan Untuk Menentukan Konfigurasi Elektron, Teknik Penulisan Konfigurasi Elektron, Konfigurasi Elektron Ion, dan Hubungan Konfigurasi elektron dengan Sistem Periodik Unsur.
Elektron mengorbit pada tingkat energi tertentu disebut kulit. Kulit elektron ialah sekelompok orbital dengan tingkat energi sama. Selain adanya kulit, terdapat juga sub kulit yang ialah sekelompok orbita-orbital yang sempunyai label orbital yang sama, yaitu yang mempunyai nilai n dan l yang sama. Sehingga tiga orbital 2p membentuk subkulit. Pemodelan ini dibentuk oleh Neils Bohr yang ialah orang pertama mengusulkan perioditas dalam tabel periodik dan sanggup dijabarkan dengan struktur elektron dalam atom.
 |
| KONFIGURASI ELEKTRON |
Lalu, setelah klarifikasi diatas, apa itu konfigurasi elektron?
A. PENGERTIAN KONFIGURASI ELEKTRON
Konfigurasi elektron ialah susunan elektron-elektron pada sebuah atom, molekul dan struktur fisik lainnya. Sama ibarat partikel elementer lainnya, elektron mengikuti aturan mekenika kuantum dan menampilkan sifat-sifat partikel maupun gelombang.
Pengetahuan atas konfigurasi elektron atom-atom sangat berkhasiat dalam memmenolong pemahaman struktur tabel periodik unsur-unsur. Konsep ini juga beguna dalam mengambarkan ikatan kimia yang menjaga atom-atom tetap bersama.
Artikel Penunjang : Pengertian dan Jenis – Jenis Ikatan Kimia
 |
| TABEL PERIODIK |
B. SEJARAH KONFIGURASI ELEKTRON
Awalnya, Neils Bohr mengajukan model atom Bohr yang mana kulit-kulit elektronnya berbentuk orbit dengan jarak yang tetap dari inti atom. Konfigurasi awal Bohr tidak sama dengan yang kini ini dipakai : contohnya welirang berkonfigurasi 2.4.4.6 daripada 1s2 2s2 2p2 dst.
Stu tahun kemudian, E.C Stoner memasukkan bilangan kuantum ketiga ke dalam deskripsi kulit elektron dan dengan benar memprediksi struktur welirang sebagai 2.8.6. Tetapi baik Bohr maupun Stoner tidak sanggup mengambarkan dengan baik perubahan spektra atom dan medan magnet.
Lalu, dengan meminta menolongan Wolfgang Pauli, yang menyadari bahwa efek Zeeman diakibatkan oleh elektron terluar atom. Ia juga sanggup menghasilkan kembali struktur kulit stoner yang benar dengan pemasukan sebuah bilangan kuantum keempat.
Persamaan lainnya yaitu Schodinger menghasilkan tiga dari empat bilangan kuantum sebagai konsekuensi penyelesaian untuk atom Hidrogen. Penyelesaian ini menghasilkan orbital-orbital atom yang sanggup kita temukan dalm buku-buku teks kimia. Kajian spektra atom sanggup ditentukan secara eksperimen yang pada balasannya menghasilkan kaidah empiris untuk urutan orbital atom mana yang terlebih lampau diisi elektron.
C. KONFIGURASI ELEKTRON BERDASARKAN KULIT ATOM
Konfigurasi elektron di setiap kulit atom sanggup terisi elektron maksimum 2n2, dimana n ialah urutan kulit atom.
- Jika n = 1 maka 2n2 sama dengan 2 elektron
- Jika n = 2 maka 2n2 sama dengan 8 elektron
- Jika n = 3 maka 2n2 sama dengan 18 elektron
- Jika n = 4 maka 2n2 sama dengan 32 elektron
Setiap kulit mempunyai lambang dimana K sama dengan kulit pertama erat dengan inti atom, L sesudahnya, M setelah L, dan N setelah M. Banyaknya kulit yang terisi elektron mengatakan periode. Elektron disusun sedemikian rupa pada masing-masing kulit dan diisi maksimum sesuai daya tampung kulitnya. Jika masih ada sisa elektron yang tidak sanggup lagi ditampung pada kulit tersebut maka diletakkan pada kulit selanjutnya.
 |
| PENGISIAN KONFIGURASI ATOM PADA ATOM GOLONGAN UTAMA |
Tabel diatas ialah pengisian konfigurasi elektron pada atom golongan utama.
D. ELEKTRON VALENSI
Elektron yang berperan dalam reaksi pembentukan ikatan kimia dan dalam reaksi kimia ialah elktron terluar atau elektron valensi. Jumlah elktron valensi ditentukan menurut elektron yang terdapat pada kulit terakhir dari konfigurasi elektron atom tersebut. Unsur yang mempunyai jumlah elektron valensi yang sama akan mempunyai sifat kimia yang sama pula.
 |
| ELEKTRON VALENSI |
Tabel diatas ialah tabel penentuan jumlah elektron valensi sekaligus hubungan konfigurasi elektron dan elektron valensi.
E. PERATURAN UNTUK MENENTUKAN KONFIGURASI ELEKTRON
Dalam penentuan konfigurasi sebuah atom, tidak sanggup kita dengan gampangnya melakukannya tanpa mengetahui aturan-aturannya. Ada 3 aturan yang harus diperhitungkan yaitu asas aufbau, larangan pauli dan kaidah hund.
1. Asas Aufbau
Menurut aasas ini, elektron dalam atom sebisa mungkin mempunyai energi terendah. Pengisian elektron pada orbital selalu dimulai dari orbital 1s atau tingkat energi terendah. Jika orbitas 1s sudah penuh, elektron akan masuk ke dalam orbital 2s, demikian seterusnya.
Besarnya tingkat orbital bergantung pada harga bilangan kuantum utama (n) dan bilangan kuantum azimuth (l). Orbital dengan harga n+ l lebih besar mempunyai tingkat energi lebih besar. Bila harga n+ l sama maka orbital yang mempunyai harga n lebih besar mempunyai energi yang lebih besar.
Urutan tingkat energi dalam pengisian elektron sebagai diberikut .
 |
| PENGISIAN ELEKTRON |
2. Larangan Pauli
Asas larangan pauli sebut mustahil dalam sebuah atom ada dua elektron dengan harga keempat bilangan kuantum yang sama. Maksudnya, dalam sebuah atom, dua buah elektron mungkin mempunyai harga n, l, dan ml yang sama, tetapi harga snya niscaya tidak sama. Jadi, larangan pauli mengambarkan suatu orbital maksimum yang spesialuntuk sanggup ditempati dua elektron yang arah spinnya berlawanan. Subkulit s mempunyai 1 orbital, elektron terbaiknya 2.
- Subkulit p mempunyai 3 orbital dan elektron maksimumnya 6
- Subkulit p mempunyai 5 orbital dan elektron maksimumnya 10
- Subkulit p mempunyai 7 orbital dan elektron maksimumnya 14
- Jumlah maksimum elektron pada kulit ke –n = 2n2.
3. Kaidah Hund
Pada pengisian orbital-orbital yang berenergi sama maka elektron akan menempati orbital secara sendiri-sendiri dengan spin yang paralel kemudian gres berpasangan. Keadaan ennergi terendah ialah yang mempunyai elektron tak berpasangan yang paling banyak.
misalnya pada subkulit p dengan l = 1 dan ml = +1,0,-1 maka elektron maksimumnya 6. Urutan pengisian elektron dalam orbital sebagai diberikut.
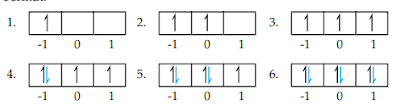 |
| URUTAN PENGISINA ELEKTRON DALAM ORBITAL |
misal konfigurasi elektron unsur C (Z = 6)
Pengisiannya sebagai diberikut : 2 elektron menempati orbital subkulit 1s diberikutnya 2 elektron menempati 2s dan sisanya 2 elektron menempati orbital-orbital 2p secara paralel.
 |
| CONTOH KONFIGURASI ELEKTRON UNSUR |
F. CARA PENULISAN KONFIGURASI ELEKTRON
1. Dua cara penulisan urutan subkulit
Subkulit ditulis menurut urutan tingkat energinya
misal :
Subkulit ditulis sesuai urutan nomor kulit yang sama kemudian untuk kulit diberikutnya lebih tinggi
misal :
2. Penyingkatan memakai konfigurasi elektron gas mulia terdekat
misal :
Gas mulia terdekat sebelumnya adalah
Maka konfigurasinya sanggup disingkat
Beberapa tumpuan lainnya :
3. Orbital penuh dan setengah penuh
Berdasarkan percobaan sanggup ditunjukkan bahwa orbital yang terisi penuh atau setengah penuh ialah struktur yang relatif lebih stabil. Ada beberapa penyimpangan pengisian elektron menurut atauran aufbau dengan menurut percobaan.
 |
| ORBITA PENUH DAN SETENGAH PENUH |
Hal tersebut terjadi alasannya ialah orbital setengah penuh (d5) dan penuh (d10) lebih stabil.
G. KONFIGURASI ELEKTRON ION
Ion kasatmata terbentuk dari atom netral dengan melepas elktron pada kulit terluarnya.
Penulisannya :
Ion positip Lx+ yang artinya melepaskan elektron sebanyak x
Ion negatip Ay- yang artinya menangkap elektron sebanyak y
Ion negatif terbentuk dari atom netral dengan menarikdanunik elektron untuk mengisi orbit dari subkulit terluar yang belum penuh.
misal:
 |
H. HUBUNGAN KONFIGURASI ELEKTRON DENGAN SISTEM PERIODIK UNSUR
Konfigurasi elektron dengan sistem periodek unsur selalu berkesinambungan satu sama lainnya. Dari konfigurasi elektron suatu aton sanggup diperkirakan letak unsur dalam tabel periodiknya. Konfigurasi sebenarnya harus ditentukan dengan percobaan.
 |
| HUBUNGAN KONFIGURASI ELEKTRON DENGAN SISTEM PERIODIK UNSUR |
Percobaan sanggup dilakukan dengan penentuan elektron valensi yang mengatakan periode unsur dalam tabel periodik. Penentuan golongan sanggup dilihat dari elktron terakhir yang mengisi subkulit. contohnya elektron yang mengisi subkulit s pada sp terletak pada gol IA atau IIA, elektron yang mengisi subkulit p pada sp terletak pada gol IIIA hingga dengan VIIIA, kalau elektron terakhir mengisi sub kulit d pada s terletak pada gol B.
Nah itulah pembahasan kita pada artikel kali ini Tentang Konfigurasi Elektron. cepatdangampang praktis sanggup bermanfaa. Apabila masih ada yang belum dimengerti, silahkan sobat erat mengisikannya di kotak komentar di bawah. Terimakasih sudah berkunjung di Atap Ilmu, tidakboleh lupa like, follow, dan komentarnya ya J
Sumber https://www.softilmu.com



Post a Comment for "Konfigurasi Elektron Dan Elektron Valensi"